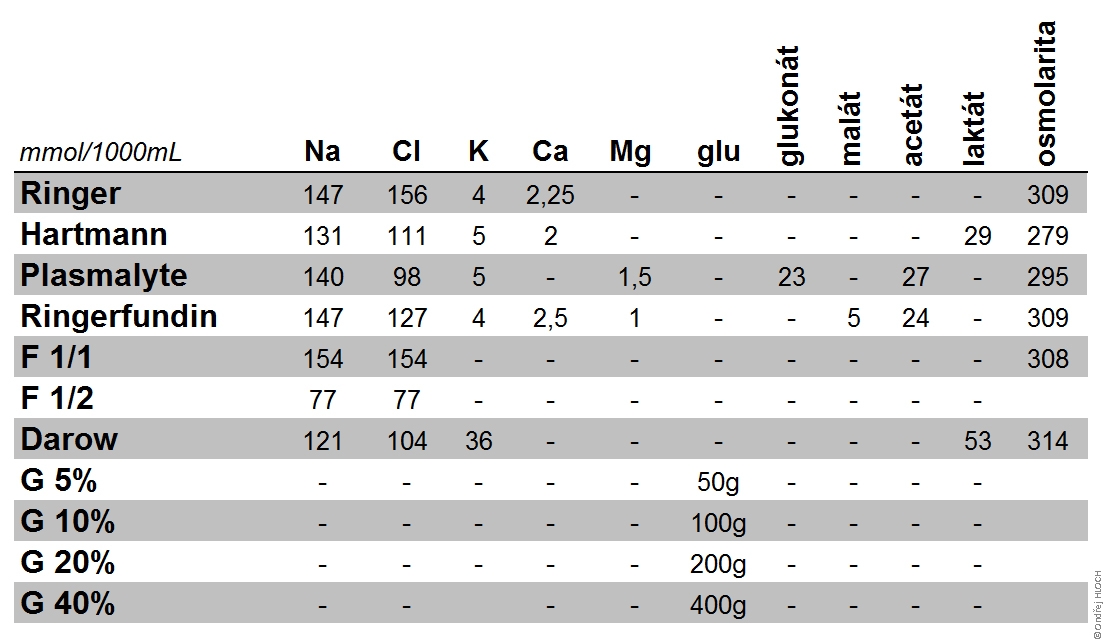
Voda a elektrolyty jsou hlavními složkami vnitřního prostředí.
celková tělesná voda CTV je 50 – 70 % celkové tělesné hmotnosti, dále se dělí do následujících prostor:
- Intracelulární ICT – 40%
- Extracelulární ECT – tekutina tvoří 20% a ta se dále dělí na intersticiální (IST 15% tkáňový mok),intravaskulární 5% (krevní plasma PT)
- Transcelulární tekutina TT – např. tekutina v trávicím traktu, ve vývodném systému ledvin
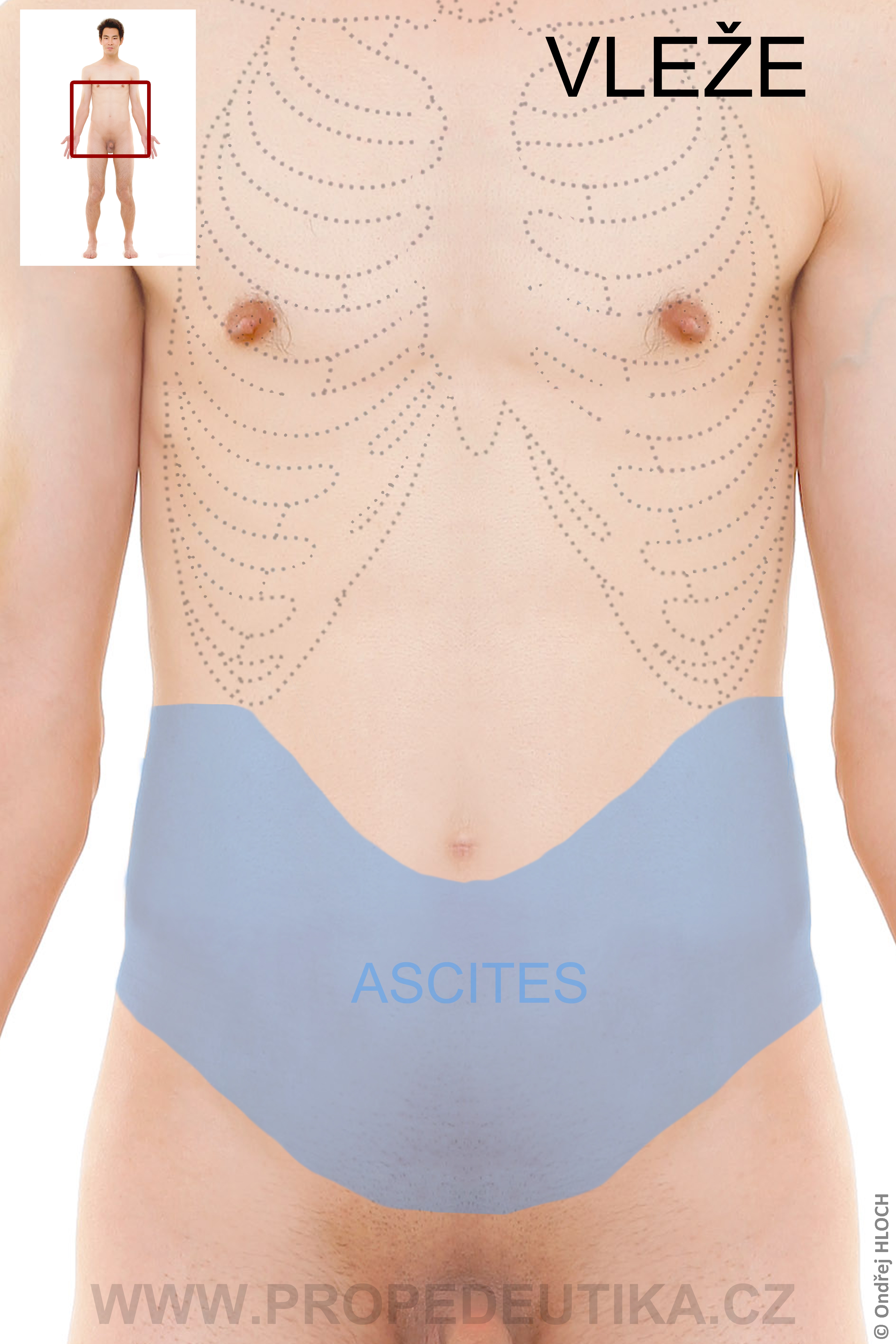
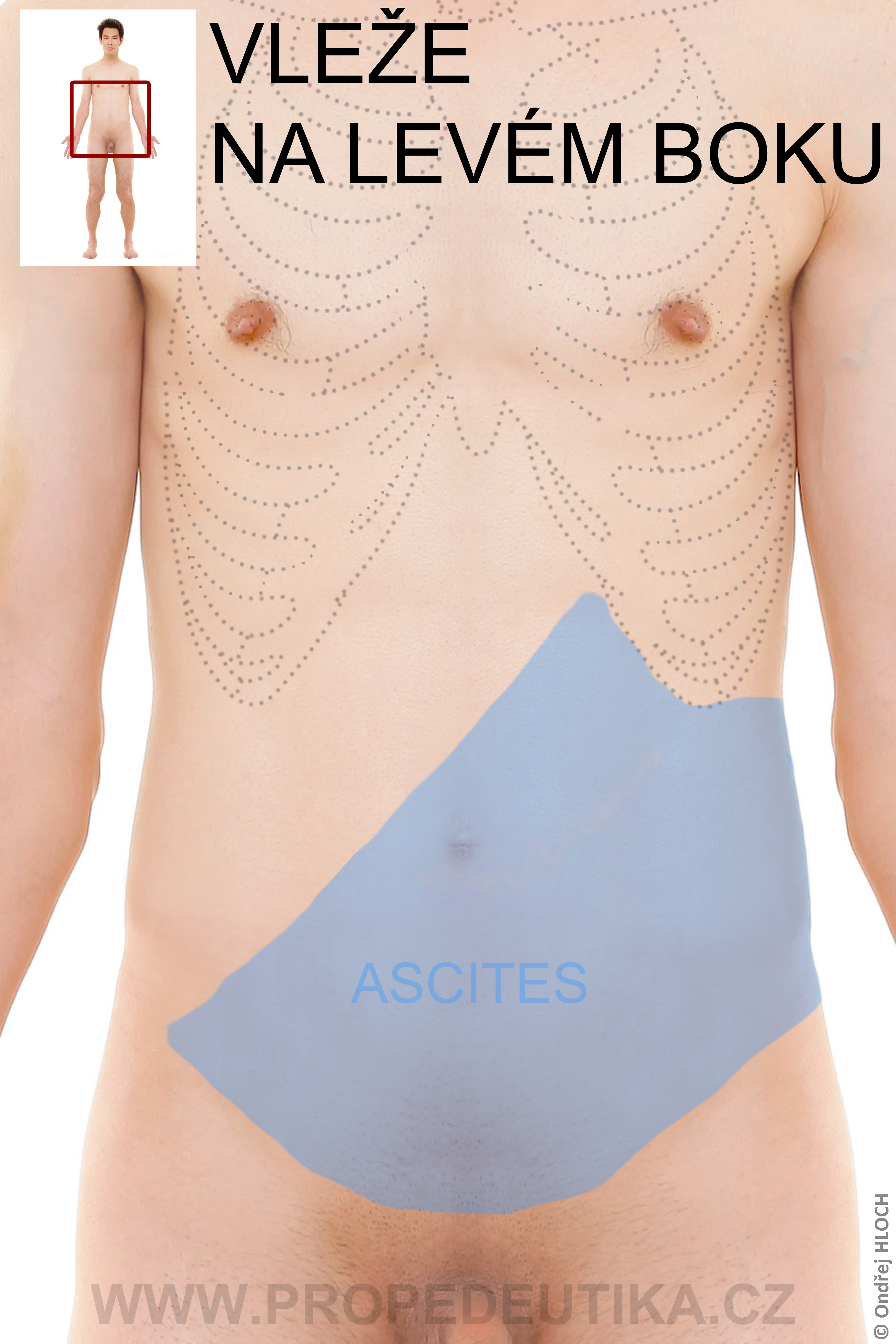
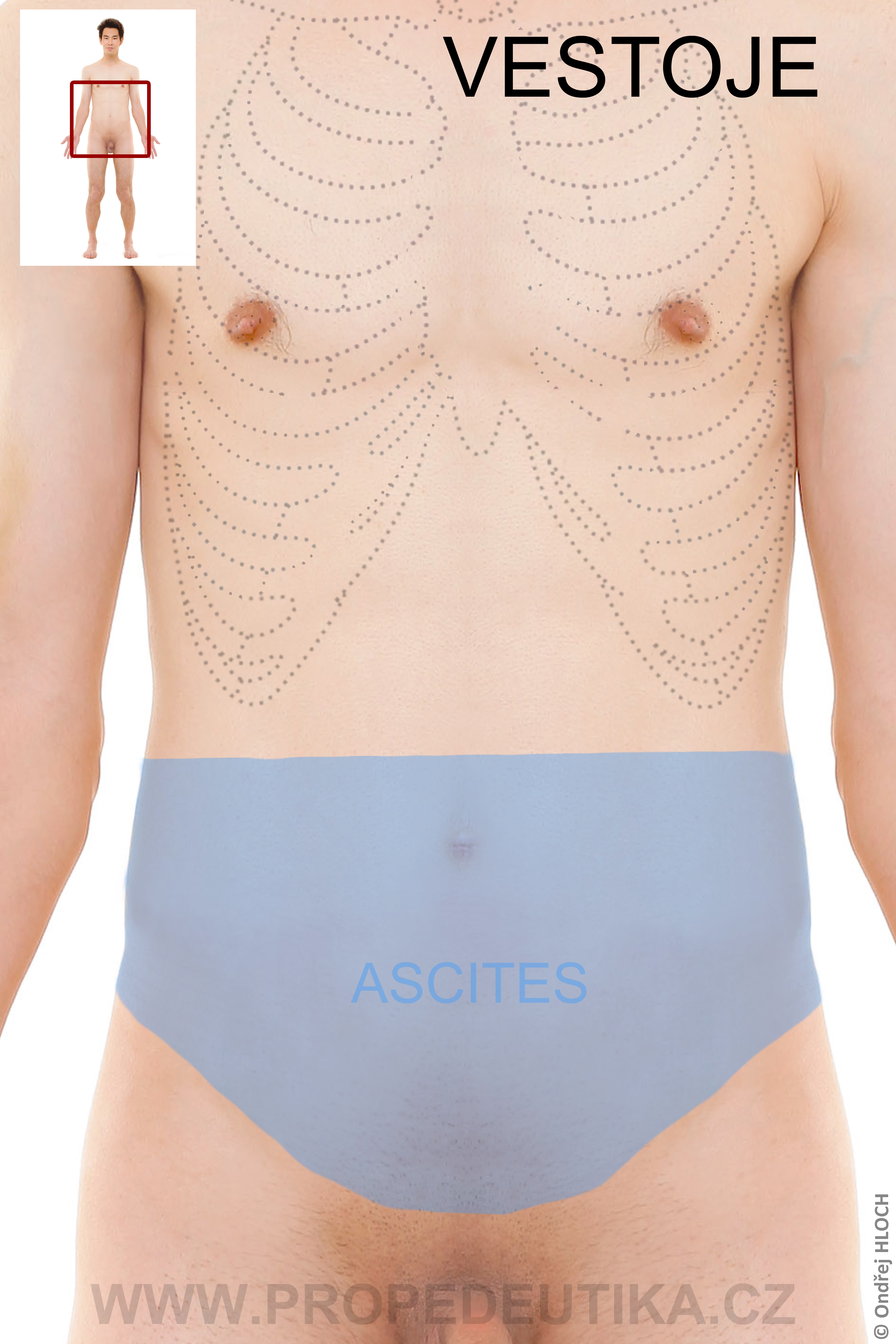
- Třetí prostor – je tekutina, která se objevuje za patologických podmínek, může mít velký objem (příkladem je ascites)
Osmolarita, osmolalita
Osmolarita je definovaná jako látková koncentrace rozpuštěných částic (mol/l roztoku), osmolalita je látkové množství částic na kg rozpouštědla, jednotkou osmolality je osmol.
Udržení konstantního objemu buněk je nezbytné pro jejich existenci a normální funkci. Za fyziologických podmínek a hlavně za patologických podmínek, je objem buňky vystaven vlivu změn osmotického tlaku v intracelulárním a extracelulárním prostředí.
Osmotický gradient
za normálních podmínek je osmotická koncentrace mezi intracelulárním a extracelulárním prostorem stejná, změna způsobí změnu v osmotického gradientu. Membrány buněk volně propouštějí vodu, tok vody je ukončen až při opětovném vyrovnání osmotické rovnováhy. Tok vody je vždy z místa s nízkou osmolaritou do místa s vyšší osmolaritou. Což vede buď k otoku buňky či jejímu svráštění. Nejvíce citlivé na tyto změny jsou mozkové buňky. Objem buňky může být zvětšen či zmenšen změnou osmoticky aktivních látek uvnitř buňky. Uplatňují se anorganické ionty: zejména Na, K, Cl, malé organické osmolity: polyoly (sorbitol, aminokyseliny a jejich deriváty – například – taurin, alanin,) glukóza a urea
Význam vyšetření osmolarity plasmy
Hodnoty objemu jednotlivých tělesných tekutin mají význam pro výpočet deficitu či nadbytku, všech osmoticky aktivních látek v jednotlivých tělesných oddílech. U člověka je dostupná k vyšetření pouze intravaskulární tekutina, proto se vyšetřuje plazma. Složení iontů plasmy a intersticiální tekutiny je velice podobné, ale určité odchylky se vytvářejí v důsledků Donnanova efektu. Intersticiální tekutina je ultrafiltrátem krevní plasmy s minimem bílkovin. Aby byla zachována elektroenutralita při sníženém obsahu bílkovin v intersticiální tekutině je zvýšena koncetrace aniontů Cl a HCO3 a koncentrace Na iontů. Čímž je ustanovena nová rovnováha tzv. Gibbsova-Donnanova.
Patofyziologie
Osmolarita séra je udržována v rozmezí 275 – 295 mmol/l . Při jejím zvýšení nad 278 se začíná zvyšovat sekrece vasopresinu. Ta pak stoupá plynule až do osmolality 296 až 298 mmol/l, kdy je sekrece maximální. Při zvyšování osmotické hladiny séra se současně zvyšuje i osmolarita moče. Za fziologických podmínek je osmolarita moči 600 – 1200 mmol/ 24 den. Vylučování denní osmotické nálože močí může někdy i za fyziologických okolností překročit referenční meze. Např. u zdravých osob se zvýšeným příjmem bílkovin a soli a velkou fyzickou aktivitou mohou hodnoty přesáhnout až 1500 mmol/24 h. Při tělesním klidu a nízkém příjmu bílkovin naopak hodnoty mohou klesnout pod normu. V hyperkatabolickýh stavech je naopak vylučování osmotické nálože významně zvýšeno. Na tomto vylučování se podílejí vysoké hodnoty urey, iontů a časté glykosurie při zhoršené toleranci glukózy a také osmoterapeutika (Manitol). O osmolaritě plazmy rozhoduje především Na+ a jemu odpovídající anionty a neionizované sloučeniny, urea, kreat, glykémie a v malé míře bílkoviny. Podíl urey se zvýrazňuje za jejího patologického retinování, glukóza přichází ke slovu při dekompenzaci diabetu mellitu. Podíl bílkovin je významný pro koloidně osmotický tlak, který udržuje cirkulujících tekutinu v cévním řečišti.
Efektivní osmotický tlak :
urea prochází volně všemi membránami – proto zvýšení její koncentrace nevede k tvorbě trvalejšího gradientu mezi prostorami tělesných tekutin.
Zvýšení glykémie v extracelulárním prostoru zvýší efektivní osmotický tlak v tomto prostoru. To vede k přesouvání vody z ICT do ECT tak dlouho, až je opět dosaženo osmotické rovnováhy. Stejný důsledek má i koncentrace Na + v extracelulárním prostoru.
Bílkoviny a polysacharidy neprocházejí membránami, proto náhradními roztoky polysacharidové povahy můžeme doplnit ECT (dextran, hydroxethylškrob).
Vyšetřovací metody
- měření osmolality v séru, provádí laboratoř z krevního vzorku. Jednotkou je mosm/kg
- odhad výpočtem z koncentrace Na+, urey a glykémie
osmolalita mmol/kg H2O = 2 [Na+] mmol/l + [urea] mmol/l + [glykémie] mmol/l. (1)
Osmotická mezera (Osmolality gap)
hodnoty získané výše uvedenou metodou se liší o 5-10 mmol/kg H2O od měřené ( norma pod 10). Pokud je rozdíl vyšší mluví se o tzv. „Osmolal gap.“, které nás vede k podezření na přítomnost látek o malé molekule, s nimiž výpočet nepočítá. Např. toxiny, acetylsalicylová kyselina, alkohol a manitol
Hyperosmolární syndrom
- může vzniknout akutně či chronicky
- hodnoty osmolality nad 310mmol/l
- kritické hodnoty nad 350 mmol/l
možné příčiny: ztráta čisté vody, diabetes mellitus – hyperglykémie, popáleniny, akutní katabolismus, těžká sepse, akutní intoxikace látkami o malé molekule, diabetés insipidus, tonutí ve slané vodě, může být u selhání ledvin – urémie, akutní i chronická pankreatitida, těžké průjmy
Iatrogeně můžeme hyperosmolaritu navodit při nevhodně podané parenterální či enterální výživě, u dialýzy hyperosmolárním roztokem, kortikoidy, glukagonem, adrenalinem, vysokými dávkami bikarbonátu, podáním látek o malé molekule.
Patofyziologie
Dochází k zvýšení efektivní osmolality v ECT a přesunu vody z IC do EC prostoru (z buněk do Výjimka je šokový stav, kdy dochází k nahromadění metabolických meziproduktů v buňkách, z důvodu poruchy energetiky buňky nemohou být metabolizovány a proto dochází k přesunu vody do buněk a snížení objemu ETC.
Nejcitlivější na tuto změnu je mozková buňka, dochází k difuzním neuronálním funkčním poruchám s možným ložiskovým maximem.
Při delším přetrvávání akutně vzniklé hyperosmolarity dochází ke snaze buněk vyrovnat osmotický gradient zvýšením osmoticky aktivních látek v buňce. Jde o více organických sloučenin (polyoly, aminokyseliny, aminy, cholinové sloučeniny, fosfokreatinin). Toto umožní doplnit objem na původní.
Laboratorní nález:
v séru stoupá osmolalita, hladina Na+ a Cl-, urey nebo glykémie
Klinický obraz :
neuropsychické poruchy, třes , halucinace, pocit žízně, bolesti hlavy, obluzení, hypertermie, poruchy vědomí až kóma, křeče, ložisková neurologická symptomatika. Smrt nastává zástavou dechu, renálním selháním, krvácením do mozku.
Cave: tento obraz u starých lidí může být zaměněn za projev sklerózy mozkových cév a podceněn
Hypoosmolární syndrom
- při akutních stavech se klinicky manifestuje pokles natremie pod 125 mmol/l, osmolality pod 265 mmol/kg H2O.
- při chronických stavech se manifestuje při nátrémii pod 120 mmo/l, osmolaritě pod 250 mmol/kg
příčiny: nadbytek čisté vody, metabolická odpověď na trauma, nadměrná sekrece ADH při stresu či bolesti , chronický katabolismus, tonutí ve sladké vodě, úhrada izotonické tekutiny vodou, z léku se může uplatnit: barbituráty, nikotin, tolbutamid; iatrogeně: léčba diuretiky, podávání hypoosmolárních infuzních roztoků (glukóza)
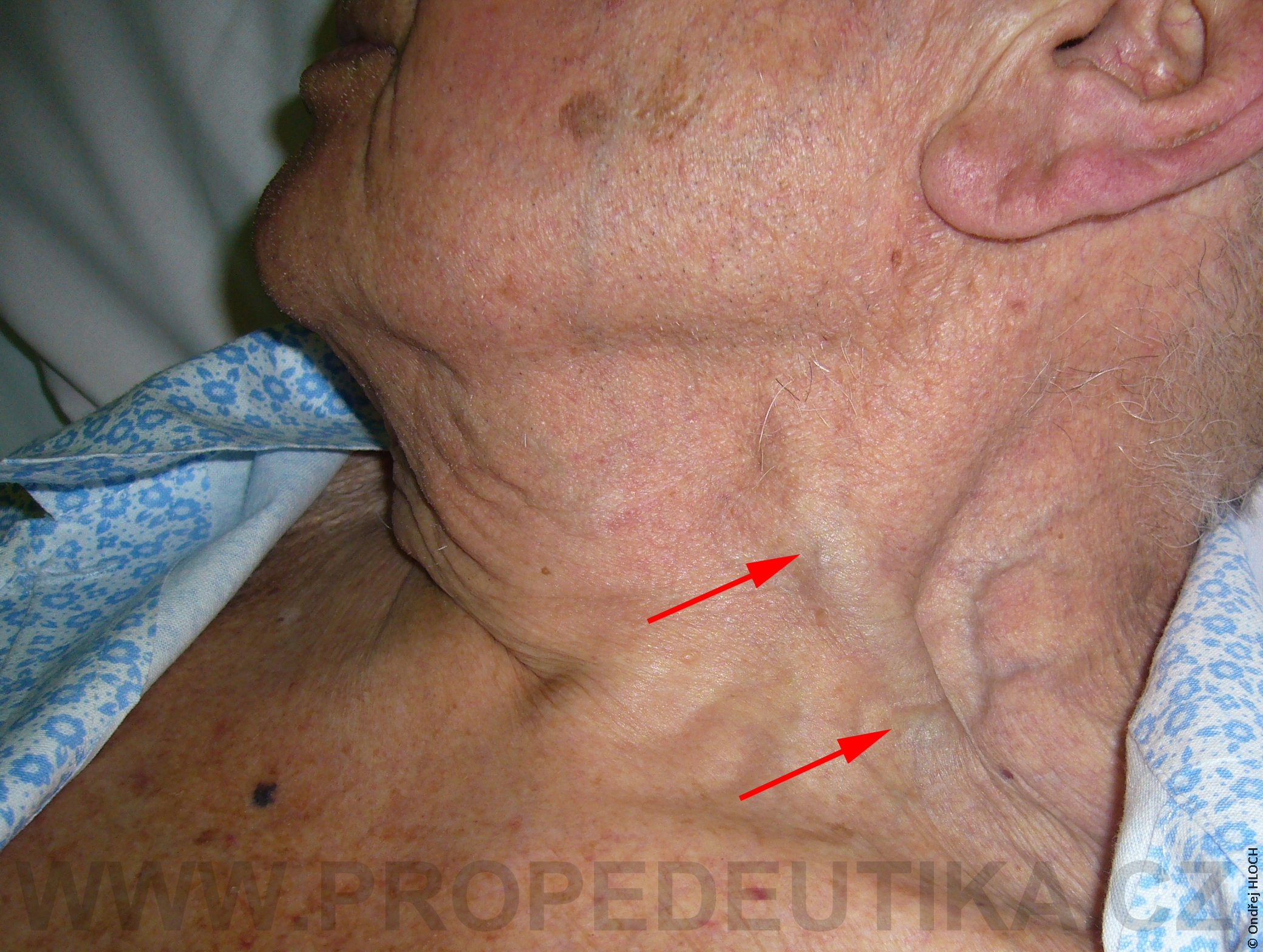
Dochází k přesunu tekutiny z ECT do ICT (z oběhu do buněk) vzniká edém .
Vzniká difuzní edém mozku a nebezpečí herniace kmene mozkového, bílkovina v likvoru je nízká pod 0,1g/L. Kompenzačním mechanismem zde je snížení osmoticky aktivních částic v mozkových buňkách
Laboratorně : v séru klesá osmolarita, nízké Na+ a Cl-
objevuje se slabost, nevolnost, apatie a opět bolesti hlavy, kóma.
Terapie poruch osmolarity
- má probíhat pomalu osmolalita by se neměla měnit prudčeji než o 2 – 4 mmol/kgH2O/ hod
- natremie se nesmí měnit rychleji něž 1 až 2 mmol/hod
- celková změna za 24 hodin nemá být větší než 20 – 30 mmol/kg H2O., natremie o 10 -12 mmol/l
Cave: rychlá úprava osmolarity u hypoosmolárních stavu vede k demyelinizace CNS, nejprve v oblasti pontu později i dále. Klinicky se projevuje jako pseudobulbární ochrnutí, chabé kvadruplegie, zhoršení citlivosti. Toto je v důsledku kompenzačního mechanizmu, který se vyvine u chronické hypoosmolarity.
Literatura
Klener Pavel et al. Vnitřní lékařství, třetí přepracované a doplněné vydání, 2006, 830-838
Kocna Petr a Loub Lukáš, Vybrané kapitoly z klinické biochemie, dostupné na http://www1.lf1.cuni.cz/~kocna/biochem/text12.htm
Dostálová Květoslava , Vnitřní prostředí , dostupné na http://video.upol.cz/
dpx_enterprise_media_user/dpx/slidemedia/27/10_01.pdf
MUDr.Pavlína Hellerová
pavlina.hellerova@fnmotol.cz